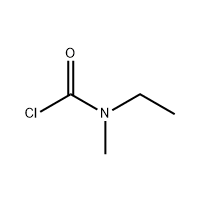
3'-αμινο-2'-υδροξυ-[1,1'-διφαινυλ]-3-καρβοξυλικό οξύ
3'-αμινο-2'-υδροξυ-[1,1'-διφαινυλ]-3-καρβοξυλικό οξύ
Το 3'-αμινο-2'-υδροξυ-[1,1'-διφαινυ]-3-καρβοξυλικό οξύ χρησιμοποιείται ως το ενδιάμεσο του Eltrombopag.
Το Eltrombopag, που αναπτύχθηκε από την GlaxoSmithKline (GSK) στο Ηνωμένο Βασίλειο και αργότερα αναπτύχθηκε από κοινού με τη Novartis στην Ελβετία, είναι ο πρώτος και μοναδικός εγκεκριμένος μικρομοριακός μη πεπτιδικός αγωνιστής υποδοχέα TPO στον κόσμο.Το Eltrombopag εγκρίθηκε από τον FDA των ΗΠΑ το 2008 για τη θεραπεία της ιδιοπαθούς θρομβοπενικής πορφύρας (ITP) και το 2014 για τη θεραπεία της σοβαρής απλαστικής αναιμίας (AA).Είναι επίσης το πρώτο φάρμακο που εγκρίθηκε από τον FDA των ΗΠΑ για τη θεραπεία της ΑΑ τα τελευταία 30 χρόνια.
Τον Δεκέμβριο του 2012, η FDA των ΗΠΑ ενέκρινε το Eltrombopag για τη θεραπεία της θρομβοπενίας σε ασθενείς με χρόνια ηπατίτιδα C (CHC), έτσι ώστε οι ασθενείς με ηπατίτιδα C με κακή πρόγνωση λόγω χαμηλού αριθμού αιμοπεταλίων να μπορούν να ξεκινήσουν και να διατηρήσουν την τυπική θεραπεία με βάση την ιντερφερόνη για ηπατικές παθήσεις.Στις 3 Φεβρουαρίου 2014, η GlaxoSmithKline ανακοίνωσε ότι ο FDA χορήγησε την πρωτοποριακή πιστοποίηση φαρμάκου θεραπείας του Eltrombopag για τη θεραπεία της αιμοπενίας σε ασθενείς με σοβαρή απλαστική αναιμία χημικού βιβλίου (SAA) που δεν ανταποκρίθηκαν πλήρως στην ανοσοθεραπεία.Στις 24 Αυγούστου 2015, ο FDA των ΗΠΑ ενέκρινε το Eltrombopag για τη θεραπεία της θρομβοπενίας σε ενήλικες και παιδιά ηλικίας 1 έτους και άνω με χρόνια ανοσοθρομβοπενία (ITP) που έχουν ανεπαρκή ανταπόκριση σε κορτικοστεροειδή, ανοσοσφαιρίνες ή σπληνεκτομή.Στις 4 Ιανουαρίου 2018, το Eltrombopag εγκρίθηκε για εισαγωγή στην Κίνα για τη θεραπεία της πρωτοπαθούς ανοσοθρομβοπενίας (ITP).


![Επιλεγμένη εικόνα 3'-αμινο-2'-υδροξυ-[1,1'-διφαινυλ]-3-καρβοξυλικού οξέος](http://cdn.globalso.com/jindunchem-med/image351.png)
![3'-αμινο-2'-υδροξυ-[1,1'-διφαινυλ]-3-καρβοξυλικό οξύ](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-τετρα-Ο-ακτυλ-1-C-[4-χλωρο-3-[[4-[[(3S)-τετραϋδροφου-ραν-3-υλ]οξυ]φαινυλ]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)